INTERFERÊNCIAS DA PROGRAMAÇÃO METABÓLICA NO DESENVOLVIMENTO DA OBESIDADE E SUAS COMORBIDADES
Resumo
Objetivo: Verificar as potenciais interferências da programação metabólica no desenvolvimento da obesidade e suas comorbidades. Método: Foram consultadas as bases de dados MEDLINE e LILACS, incluindo artigos publicados entre 2004-2014 nos idiomas Português, Inglês e Espanhol, utilizando-se os descritores fetal development, obesity, chronic disease. Resultados: Dos 19 artigos identificados, cinco foram excluídos. A busca das referências a partir dos 14 estudos analisados resultou na inclusão de 38 novos trabalhos. Conclusão: Há evidências de que a nutrição intrauterina e pós-natal e o estilo de vida podem interferir na programação da saúde e do risco futuro de obesidade e de doenças crônicas.
Descritores (Palavras-chave)
Desenvolvimento Fetal; Obesidade; Doença Crônica
Introdução
A prevalência de obesidade em crianças e adultos vem aumentando de modo exponencial nas últimas duas décadas, configurando-se como importante problema de saúde pública mundial1, devido a sua associação com as comorbidades na infância e o aumento do risco de morte prematura em adultos2. Essa condição sinaliza a necessidade de se priorizar a adoção de políticas públicas na prevenção do sobrepeso e da obesidade infantil, situação nutricional envolvida na gênese das doenças cardiovasculares1.
As doenças cardiovasculares representam a principal causa de morbidade e mortalidade mundial e estão associadas ao processo da aterosclerose que pode começar na infância e se manifestar precocemente ao longo da vida. Fatores de risco como dislipidemia, hipertensão arterial, resistência à insulina, associados ou não à obesidade, aceleraram o processo aterosclerótico e aumentaram o risco de doenças cardiovasculares3. Portanto, a identificação precoce dos fatores de risco para o excesso de peso, suas comorbidades e o estabelecimento de medidas de prevenção primária são inquestionáveis para o controle desse grave problema de saude pública global4.
Estudos têm demonstrado os efeitos, da nutrição precoce e do estilo de vida na programação, em longo prazo, da saúde e do risco futuro de obesidade e doenças crônicas como diabetes mellitus tipo 2, hipertensão arterial e doenças cardiovasculares5-7. Estes efeitos transgeracionais estão sendo explicados por mutações ao nível da maquinária epigenética e podem estabelecer associações plausíveis entre a nutrição intrauterina e pós-natal e o desenvolvimento de doenças crônicas não transmissíveis na vida adulta8-10.
O fenômeno conhecido como “programação” refere-se a estímulos que, quando aplicados durante o primeiro momento da vida, podem gerar alterações permanentes que persistem ao longo da vida. Tal fenômeno não se limita apenas ao ambiente intraútero, mas se estende para a infância, onde os diferentes órgãos e sistemas continuam a adaptar-se aos diversos estímulos. Esse conceito foi descrito por David Baker, em 1986, e popularizado como uma hipótese de origem fetal das doenças no adulto, a qual se baseia no desenvolvimento da plasticidade onde um único genótipo pode originar diferentes fenótipos, influenciados por estímulos ambientais ou insultos intrauterinos. Tais adaptações têm o objetivo de preparar o feto para a vida extrauterina. Contudo, estas transformações podem não ser compatíveis com o ambiente externo, levando a um desequilíbrio que pode predispor ao maior risco de doenças na vida adulta7,11. Assim, o objetivo desta revisão é verificar os conhecimentos sobre programação metabólica e suas potenciais interferências no desenvolvimento da obesidade e suas comorbidades precoces e tardias.
Método
Foram consultadas as bases de dados eletrônicas Medical Literature Analysis and Retrieval System Online (MEDLINE) e Literatura Latino-Americana e do Caribe em Ciências da Saúde (LILACS). A pesquisa incluiu artigos publicados entre 2004 e 2014 nos idiomas português, inglês e espanhol, utilizando os termos MESH (Medical Subject Headings): fetal development, obesity echronic disease, consultados no endereço eletrônico http://www.ncbi.nlm.nih.gov/mesh.
A estratégia de busca adotada na base de dados MEDLINE/PUBMED foi: ((“Fetal Development”[Mesh]) AND “Obesity”[Mesh]) AND “Chronic Disease”[Mesh], enquanto na LILACS utilizou-se a estratégia: “Fetal Development” AND “Obesity” AND “Chronic Disease”. Foram identificados 19 artigos nas bases de dados, contudo, cinco foram excluídos devido ao período de publicação (anterior a 2004: N=03), ao idioma (francês: N=01) e ao tipo de estudo (experimental: N=01). Desta forma, foram incluídos 14 artigos, todos de revisão, sendo que 13 (92,9%) foram publicados na base de dados MEDLINE/PUBMED e um artigo (7,1%) na LILACS. A busca das referências a partir dos 14 estudos analisados resultou na inclusão de 38 novos artigos.
Resultados
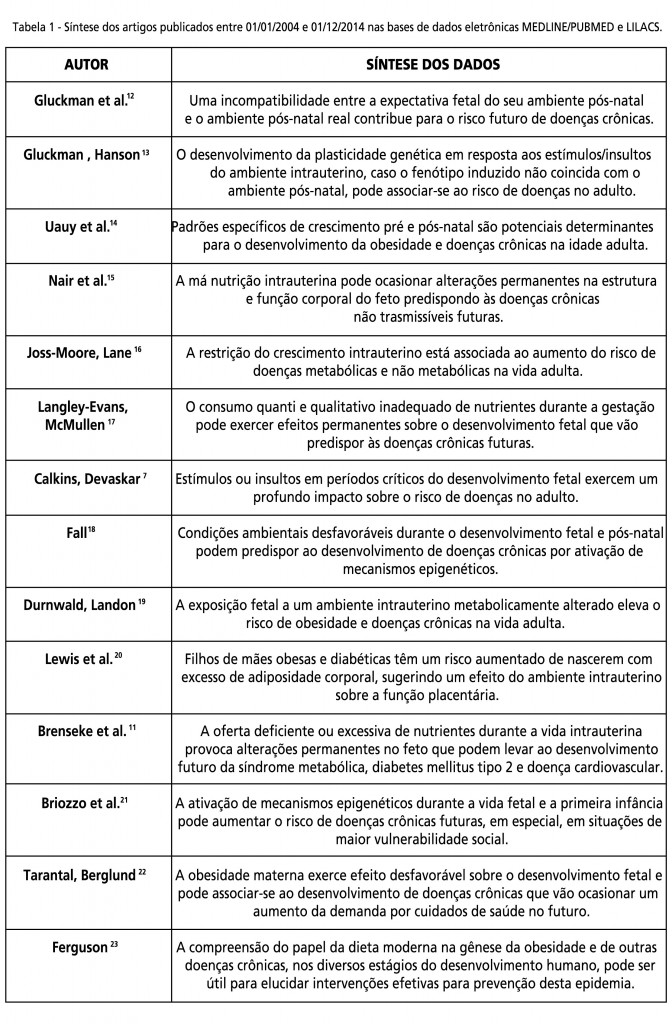
A síntese dos artigos sobre programação metabólica e suas potenciais interferências no desenvolvimento da obesidade e suas comorbidades está descrita na Tabela 1.
Discussão
A nutrição durante a gravidez pode afetar o estado de saúde das gerações futuras e esses efeitos transgeracionais parecem ser explicados por mutações na maquinária epigenética, com associações entre a nutrição intrauterina e o desenvolvimento de doenças crônicas não transmissíveis na vida adulta8-10,22. Os efeitos da nutrição e do estilo de vida durante a infância, na programação da evolução nutricional desfavorável e do risco de doenças crônicas não transmissíveis são demonstrados em diversos estudos5-7,11,17.
Recentemente, três hipóteses foram propostas para explicar os efeitos da nutrição na programação da obesidade e suas comorbidades. A primeira hipótese sugere que a exposição intrauterina a um excesso de nutrientes, principalmente de glicose, provoca alterações permanentes no feto que levam à obesidade na vida pós-natal. Evidências científicas sugerem que a obesidade materna e o ganho de peso excessivo na gravidez se associam de modo independente ao risco de obesidade na infância, corroborando, assim, a primeira hipótese24.
O estado nutricional da mãe influencia a quantidade e a qualidade de nutrientes que chegam ao feto, representando um determinante potencial da programação metabólica e da composição corporal17,20,25. Nesse sentido, a presença de obesidade ou de diabetes mellitus durante a gestação foi associada à hiperinsulinemia fetal, aumento da morbimortalidade perinatal, aumento da adiposidade corporal, desenvolvimento futuro de obesidade, intolerância à glicose, hipertensão arterial, dislipidemia e síndrome metabólica19,26-27.Portanto, melhorar o controle glicêmico ou reduzir a resistência insulínica durante a gravidez, através da alimentação balanceada e de exercícios físicos regulares, pode modificar o crescimento fetal e diminuir o risco de obesidade na infância28.
A obesidade materna também foi associada a alterações no metabolismo e transporte dos ácidos graxos através da placenta, sem afetar o crescimento fetal. No entanto, essas alterações podem modificar o metabolismo do feto interferindo na formação e distribuição do tecido adiposo e na sua predisposição para desenvolver doenças cardiometabólicas futuras20,22,29.
Um estudo demonstrou que o aconselhamento dietético de mães durante a gravidez e amamentação não foi associado aos níveis séricos de lipídios de seus filhos entre um e quatro anos de idade. Mas, por outro lado, o consumo de ácidos graxos monoinsaturados por essas crianças correlacionou-se com valores de apolipoproteína A-I, havendo, também, uma correlação negativa entre consumo de ácidos graxos poliinsaturados e apolipoproteína B, indicando, dessa forma, a intervenção da dieta nas diferentes fases da vida30.
A segunda hipótese propõe uma associação entre o ganho rápido de peso na infância e o aumento do risco de obesidade futura e doenças associadas31. Há indicativos de que o maior consumo de proteínas contribui para o aumento dos níveis plasmáticos e teciduais de insulin-releasing amino acids, insulina e insulin-like growth factor 1, com consequente aumento do ganho de peso e da atividade adipogênica32. Reforça essa hipótese o fato de crianças em aleitamento materno terem um risco aproximadamente 20% menor de desenvolver obesidade futura, quando comparadas àquelas em uso de fórmula infantil. Esse efeito protetor pode estar associado ao menor conteúdo de proteína no leite humano, quando comparado às fórmulas infantis convencionais33.
Além disso, existem evidências dos efeitos benéficos da amamentação exclusiva na redução dos fatores de risco para doença cardiovascular como dislipidemia, hipertensão arterial, diabetes mellitus tipo 2, intolerância à glicose e excesso de peso34-36. O aleitamento materno exclusivo até os seis meses promove, ainda, um crescimento ótimo, desenvolvimento neurocognitivo e resistência a infecções, estando associado à saúde cardiovascular na infância e na vida adulta37.
Por outro lado, as práticas alimentares inadequadas nos primeiros anos de vida podem levar à subnutrição, retardo do crescimento, aumento do risco de morbimortalidade na infância e, consequentemente, ao aumento do risco futuro de doenças crônicas não transmissíveis38. Práticas inadequadas de alimentação complementar e seus determinantes sociodemográficos e culturais foram associados ao maior consumo de energia e maior índice de peso por estatura em crianças, com efeito potencial na modulação do risco de obesidade infantil39.
Huh et al.40 verificaram que a introdução de alimentos complementares em crianças menores de quatro meses foi associada ao risco seis vezes maior de obesidade aos três anos de vida. Foi observada, também, uma associação entre a duração do aleitamento materno, introdução precoce de alimentos sólidos e o aumento do risco de obesidade na infância41.
A distribuição adequada dos macronutrientes provenientes da alimentação complementar, introduzida a partir dos seis meses de idade, deve potencializar o crescimento adequado da infância à adolescência e prevenir os fatores de risco para o desenvolvimento de doenças crônicas não transmissíveis na vida adulta25. A ingestão de 4 a 5 g/Kg/dia de proteína, por crianças de oito a 24 meses, está associada ao aumento do risco futuro de sobrepeso42, do mesmo modo que o consumo excessivo de sódio na primeira infância pode levar ao desenvolvimento tardio de doença cardiovascular43. Não foram observadas evidências da associação entre ingestão de gorduras e aumento subsequente de peso e adiposidade corporal em crianças44, mas o consumo de alimentos com alta densidade energética pode induzir o ganho excessivo de peso45.
A última hipótese sugere que a incompatibilidade entre o desenvolvimento pré e pós-natal subótimo e um ambiente obesogênico na infância estão relacionados à maior predisposição à obesidade e outras comorbidades futuras. Essa associação pode ser atribuída a um estímulo ou insulto, em um período crítico do desenvolvimento, no qual o feto produz o fenótipo mais adequado à sua sobrevivência, o que leva ao desenvolvimento de adaptações anatômicas, endócrinas e/ou metabólicas irreversíveis, com consequências tardias que podem se manifestar na infância ou na vida adulta,5,12-13 em especial, em um contexto social de maior vulnerabilidade21.
Mudanças na composição celular de tecidos, induzidas por condições intrauterinas subótimas, podem influenciar a função fisiológica pós-natal. Evidências sugerem que o fígado pode representar um orgão alvo para a programação metabólica, passando por mudanças epigenéticas, funcionais e estruturais, após exposição a um ambiente intrauterino desfavorável, que podem aumentar o risco futuro de doenças cardiometabólicas46.
Recém-nascidos, pequenos para idade gestacional e com déficit estatural na infância, têm um risco aumentado para desenvolver doenças cardiovasculares na vida adulta, especialmente quando o déficit estatural é seguido por ganho de peso aumentado47. Desta forma, a avaliação de rotina do crescimento linear e o monitoramento do ganho de peso nos primeiros dois a três anos de vida são potenciais estratégias para controle da obesidade infantil e para prevenção das doenças crônicas não transmissíveis, dentre elas, as doenças cardiovasculares14.
Do mesmo modo, a correlação do peso ao nascer e fatores de risco para doença cardiovascular têm sido estudada nas últimas décadas. O baixo peso ao nascer foi associado ao desenvolvimento tardio de um conjunto de desordens que inclui adiposidade abdominal, hipertensão arterial, dislipidemia, resistência à insulina, hiperinsulinemia, intolerância à glicose, diabetes mellitus tipo 2, síndrome metabólica e doença cardiovascular15,48-50. A macrossomia fetal também foi associada ao desenvolvimento tardio de obesidade, diabetes mellitus tipo 2 e dislipidemia51.
Os mecanismos genéticos envolvidos na gênese da obesidade ainda não estão totalmente esclarecidos, mas os principais objetivos da pesquisa epigenética em relação à obesidade consistem em: a) buscar marcadores epigenéticos para prever futuros problemas de saúde ou detectar os indivíduos em maior risco; b) entender os fatores ambientais relacionados com a obesidade que podem modular a expressão do gene, afetando mecanismos epigenéticos; c) estudar novas estratégias terapêuticas com base em agentes nutricionais ou farmacológicos que podem modificar marcas epigenéticas52.
Assim, os estudos evidenciam que a nutrição intrauterina e pós-natal e o estilo de vida podem interferir na programação da saúde e do risco futuro de obesidade e de doenças crônicas. Essas evidências atuais devem ser consideradas na formulação de políticas públicas voltadas para reverter os índices crescentes de obesidade e outras comorbidades precoces e tardias. Estudos futuros são necessários para avaliar o impacto da alimentação infantil e, em especial, do aleitamento materno, da alimentação complementar e da composição de fórmulas infantis, na redução do risco de obesidade e outras doenças associadas nas gerações subsequentes.
Da mesma forma, deve-se valorizar as diretrizes políticas relacionadas ao pré-natal de qualidade, no sentido de se prevenir os insultos intrauterinos e um seguimento adequado no período peri e pós-natal, para identificar e corrigir riscos associados às doenças crônicas não transmissíveis na idade adulta.
Referências
- Koletzko B, Brands B, Poston L, Godfrey K, Demmelmair H, for the Early Nutrition Project. Early nutrition programming of long-term health. Proceedings of the Nutrition Society. 2012;71:371–8.
- Olza J, Gil-Campos M, Leis R et al. Presence of the metabolic syndrome in obese children at prepubertal age. Ann Nutr Metab. 2011;58:343–50.
- Liu A, Hills AP, Hu X, Li Y, Du L, Xu Y, Byrne NM, Ma G. Waist circunference cut-off values for the prediction of cardiovascular risk factors clustering in Chinese school-aged children: a cross-sectional study. Public Health. 2010;10:82-90.
- Weintraub WS, Daniels SR, Burke LE, Franklin BA, Goff DC Jr, Hayman LL et al. Heart Association Advocacy Coordinating Committee; Council on Cardiovascular Disease in the Young; Council on the Kidney in Cardiovascular Disease; Council on Epidemiology and Prevention; Council on Cardiovascular Nursing; Council on Arteriosclerosis; Thrombosis and Vascular Biology; Council on Clinical Cardiology, and Stroke Council: Value of primordial and primary prevention for cardiovascular disease: a policy statement from the American Heart Association. Circulation. 2011;124:967–90.
- Godfrey KM, Gluckman PD, Hanson MA. Developmental origins of metabolic disease: life course and intergenerational perspectives. Trends Endocrin Met. 2010;21:199–205.
- Koletzko B, Brands B, Demmelmair H. The Early-Nutrition Programming Project: five years of successful multi-disciplinary collaborative research. Am J Clin Nutr. 2011;94:1749–1753.
- Calkins K, Devaskar SU. Fetal origins of adult disease. Curr Probl Pediatr Adolesc Health Care. 2011;41:158-76.
- Ollikainen M, Smith KR, Joo EJ, Ng HK, Andronikos R, Novakovic B et al. DNA methylation analysis of multiple tissues from newborn twins reveals both genetic and intrauterine components to variation in the human neonatal epigenome. Hum Mol Genet. 2010;19:4176-88.
- Lillycrop KA. Effect of maternal diet on the epigenome: implications for human metabolic disease. Proceedings of the Nutrition Society. 2011;70:64–72.
- Soubry A, Schildkraut JM, Murtha A, Wang F, Huang Z, Bernal A et al. Paternal obesity is associated with IGF2 hypomethylation in newborns: results from a Newborn Epigenetics Study (NEST) cohort. BMC Medicine. 2013, 11:29-8.
- Brenseke B, Prater MR, Bahamonde J, Guitierrez JC. Current thoughts on maternal nutrition and fetal programming of the metabolic syndrome. J Pregnancy. 2013;ID 368461:13p.
- Gluckman PD, Hanson MA, Pinal C. The developmental origins of adult disease. Matern Child nutr. 2005;1:130-41.
- Gluckman PD, Hanson MA. Developmental plasticity and human disease: research directions. J Intern Med. 2007;261:461-71.
- Uauy R, Kain J, Mericq V, Rojas J, Carvalán C. Nutrition, child growth, and chronic disease prevention. Ann Med. 2008;40:11-20.
- Nair L, Nair MK, Chacko DS. Markers of fetal onset adult diseases. Indian Pediatr. 2009;46(Suppl):s48-54.
- Joss-Moore LA, Lane RH. The developmental origins of adult disease. Curr Opin Pediatr. 2009;21:230-4.
- Langley-Evans SC, McMullen S. Developmental origins of adult disease. Med Princ Pract. 2010;19:87-98.
- Fall CH. Fetal programming and the risk of noncommunicable disease. Indian J Pediatr. 2013;80(Suppl):s13-20.
- Durnwald C, Landon M. Fetal links to chronic disease: the role of gestational diabetes mellitus. Am J Perinatol. 2013;30:343-6.
- Lewis RM, Demmelmair H, Gaillard R, Godfrey KM, Hauguel-de Mouzon S, Huppertz B et al. The placental exposome: placental determinants of fetal adiposity and postnatal body composition. 2013;63:208-15.
- Briozzo L, Coppola F, Gesuele JP, Tamasso G. Restricción de crecimiento fetal, epigenética y transmisión trans generacional de las enfermedades crónicas y la pobreza. Horiz Med (Impresa). 2013;13:45-53.
- Tarantal AF, Berglund L. Obesity and lifespan health – importance of the fetal environment. Nutrients. 2014;6:1725-36.
- Ferguson W. Why are we failing with the epidemic of obesity and other chronic diseases? A further look at aetiopathogenesis. N Z Med J. 2014;127:92-7.
- Lamb MM, Dabelea D, Yin X et al. Early-life predictors of higher body mass index in healthy children. Ann Nutr Metab. 2010;56:16–22.
- Guardamagna O, Abello F, Cagliero P, Lughetti L. Impact of nutrition since early life on cardiovascular prevention. Italian Journal of Pediatrics. 2012,38:73-83.
- Tam WH, Ma RC, Yang X, Li AM, Ko GT, Kong AP et al. Glucose intolerance and cardiometabolic risk in adolescents exposed to maternal gestational diabetes: a 15-year follow-up study. Diabetes Care. 2010;33:382–4.
- Lehnen H, Zechner U, Haaf T. Epigenetics of gestational diabetes mellitus and offspring health: the time for action is in early stages of life. Molecular Human Reproduction. 2013;19:415–22.
- Nelson SM, Matthews P, Poston L. Maternal metabolism and obesity: modifiable determinants of pregnancy outcome. Hum Reprod Update. 2010;16:255–75.
- Dubé E, Gravel A, Martin C, Desparois G, Moussa I, Ethier-Chiasson M et al. Modulation of Fatty Acid Transport and Metabolism by Maternal Obesity in the Human Full-Term Placenta. Biology of Reproduction. 2012;87:1–11.
- Hoppu U, Isolauri E, Koskinen P, Laitinen K. Diet and blood lipids in 1-4 years-old children. Nutrition, Metabolism & Cardiovascular Diseases. 2013;23:980-6.
- Patel MS, Srinivasan M. Metabolic programming in the immediate postnatal life. Ann Nutr Metab. 2011;58(suppl 2):18–28.
- Koletzko B, Beyer J, Brands B et al. (2012a) Early Influences of Nutrition on Postnatal Growth [MGP Gillman and R Rosenfeld, editors]. Basel: Karger (In the Press).
- Turck D, Agostoni C, Braegger C et al. Breastfeeding: a commentary by the ESPGHAN committee on nutrition. J Pediatr Gastroenterol Nutr. 2009;49:112–25.
- World Health Organization: Evidence on the long-term effects of breastfeeding. Systematic reviews and meta-analyses. Geneva, Switzerland: WHO Press, World Health Organization; 2007. Available from: http://whqlibdoc.who.int/ publications/2007/. Accessed in: aug. 2013.
- Savino F, Liguori SA, Sorrenti M, Fissore MF, Oggero R. Breast Milk hormones and regulation of glucose homeostasis. Int J Pediatr. 2011;803985.
- Evelein AMV, Geerts CC, Visseren FLJ, Bots ML, van der Ent CK, Grobbee DE, Uiterwaal CSPM. The association between breastfeeding and the cardiovascular system in early childhood. Am J Clin Nutr. 2011;93:712–18.
- ESPGHAN Committee on Nutrition, Agostoni C, Braegger C, Decsi T, Kolacek S, Koletzko B, Fleischer Michaelsen et al. Breast-feeding: a commentary by the ESPGHAN committee on nutrition. J Pediatr Gastroenterol Nutr. 2009;49:112-25.
- Caulfield LE, de Onis M, Blossner M, Black RE. Undernutrition as an underlying cause of child deaths associated with diarrhea, pneumonia, malaria and measles. Am J Clin Nutr. 2004;80:193-8.
- Thompson AL, Bentley ME. The critical period of infant feeding for the development of early disparities in obesity. Social Science & Medicine. 2012;1-9.
- Huh SY, Rifas-Shiman SL, Taveras EM, Oken E, Gillman MW. Timing of solid food introduction and risk of obesity in preschool-aged children. Pediatrics. 2011;127:544-51.
- Seach KA, Dharmage SC, Lowe AJ, Dixon JB. Delayed introduction of solid feeding reduces child overweight and obesity at 10 years. Int J Obes. 2010;34:1475-9.
- Hoppe C, Molgaard C, Thomsen BL, Juul A, Michaelsen KF. Protein intake at 9 mo of age is associated with body size but not with body fat in 10-year-old Danish children. Am J Clin Nutr. 2004;79:494–501.
- Strazzullo P, Campanozzi A, Avallone S. Does salt intake in the first two years of life affect the development of cardiovascular disorders in adulthood? Nutr Metab Cardiovasc Dis. 2012, in press.
- Danckert N, Gunther ALB, Kroke A, Hornberg C, Buyken AE. How early dietary factors modify the effect of rapid weight gain in infancy on subsequent body-composition development in term children whose birth weight was appropriate for gestational age. Am J Clin Nutr. 2007;86:1700–8.
- Ong K, Loos R. Rapid infancy weight gain and subsequent obesity: systematic reviews and hopeful suggestions. Acta Paediatr. 2006;95:904–8.
- Cianfarani S, Agostoni C, Bedogni G, Canani RB, Brambilla P, Nobili V et al. Effect of intrauterine growth retardation on liver and long-term metabolic risk. International Journal of Obesity. 2012;36:1270-7.
- Barker DJP, Osmond C, Forsen TJ et al. Trajectories of growth among children who have coronary events as adults. New Engl J Med. 2005;353: 802–9.
- Barker DJ, Hales CN, Fall CH, Osmond C, Phipps K, Clark PM. Type 2 (non-insulin-dependent) diabetes mellitus, hypertension and hyperlipidaemia (syndrome X): relation to reduced fetal growth. Diabetologia. 1993;36:62-7.
- Pereira JA, Rondo PHC, Lemos JO, Pacheco SJM, Dias RSC. The influence of birth weight on arterial blood pressure of children. Clin Nutr. 2010;29:337-40.
- Meas T. Fetal origins of insulin resistance and the metabolic syndrome: A key role for adipose tissue? Diabetes Metab. 2010;36:11–20.
- Zhang J, Himes JH, Guo Y, Jiang J, Yang L, Lu Q et al. Birth weight, growth and feeding pattern in early infancy predict overweight/obesity status at two years of age: a birth cohort study of Chinese infants. PLoS One.2013;5:645-42.
- Milagro FI, Mansego ML, Miguel C, Martínez JA. Dietary factors, epigenetic modifications and obesity outcomes: Progresses and perspectives. Molecular Aspects of Medicine. 2013;34:782–812.
Anexos
Autores
Janine Pereira da Silva: DOUTORADO/UFMG – (ESTUDANTE DE PÓS-DOUTORADO).
Joel Alves Lamounier: Doutor. Departamento de Pediatria. Universidade Federal de São João Del Rei (UFSJ), São João Del Re i, MG, Brasil. – (Chefe do Departamento de Medicina da Universidade Federal de São João Del Rei (UFSJ), São João Del Re i, MG, Brasil.).
Gillyane Nico Cremasco: Graduanda de Medicina. Escola Superior de Ciências da Santa Casa de Misericórdia de Vitória (EMESCAM), Vitória, ES, Brasil. – (Graduanda de Medicina.).
Valmin Ramos-Silva: Doutor. Mestrado em Políticas Públicas e Desenvolvimento Local. Escola Superior de Ciências da Santa Casa de Misericórdia de Vitória (EMESCAM), Vitória, ES, Brasil. – (Pró-Reitor em pesquisa da Escola Superior de Ciências da Santa Casa de Misericórdia de Vitória (EMESCAM), Vitória, ES, Brasil.).



